感染症における鉄の役割
鉄は生命に必須の元素
鉄はごく一部の細菌(一部のLactobacillusなど)を除く全ての生物にとって必須の元素です1)。酸素の輸送、エネルギー産生、DNA合成などの生命活動において、鉄を活性中心にもつタンパク質・酵素※が重要な役割を果たしています。
生命は地球上に約35億年以上前に誕生したと考えられていますが2)、生物界の3つのドメインである細菌、古細菌、真核生物の共通祖先とされる最終普遍共通祖先(Last Universal Common Ancestor; LUCA)は既に鉄を利用していた可能性が指摘されています3)。生物が地球上に誕生したときの大気中の酸素分圧はほぼゼロで、鉄は水に易溶性のイオンFe2+として存在していました4)。しかし、約27億年前、地球上に初めて光合成を行う細菌シアノバクテリアが出現し5)、光合成により放出される酸素によって易溶性のFe2+の酸化が起こり、現在の地球環境下では、鉄イオンは不溶性のFe3+として存在します。
従って、鉄は豊富に存在するものの、多くの鉄が生物にとって利用しにくいFe3+の状態にあることとなりました。
- ※これらのタンパク質はヘムタンパク質と非ヘムタンパク質に分けられます。ヘムタンパク質はヘムを活性中心に持つタンパク質です6)。ヘムはポルフィリンと呼ばれる環状平面分子と鉄との錯体であり、ポルフィリン環の中心に鉄が配位しています6)。ヘムタンパク質にはヘモグロビン、ミオグロビン、オキシダーゼ*1、カタラーゼ*2などがあります7)。
非ヘムタンパク質は鉄原子が直接タンパク質(アミノ酸の側鎖が配位子となる場合が多い)に結合しています。非ヘムタンパク質にはフェリチン*3、トランスフェリン*4、ラクトフェリン*5などがあります。
*2 過酸化水素を分解し、過酸化水素を除去する8)
*3 数千個の鉄原子を保持でき、鉄を貯蔵する4)
*4 血漿に含まれ鉄を輸送する4)
*5 好中球の顆粒に含まれ、炎症が起きたときに放出される。乳汁、涙、鼻汁、唾液などにおいて産生される9)
ヒトにおける鉄代謝
鉄の吸収や利用は生体内において厳密に管理されています。
ヒトの場合、成人の生体中には約3~5gの鉄があると推測されています10)。
Fe2+は毒性が強く、Fe3+は水に難溶性であるため、生体内の鉄はキャリアー(ヘム、トランスフェリン、ラクトフェリン、フェリチン、ヘモジデリンなど)と結合しています11)。
生体内の鉄の約65%はヘモグロビンとして赤血球に、約30%がフェリチンやヘモジデリンなどの貯蔵鉄として肝臓・脾臓・骨髄などに、約3~5%はミオグロビンとして筋肉に、血中には0.1%程度がトランスフェリンと結合して分布するとされています12)(図1)。
造血や他の含鉄タンパク質の新生に必要な鉄は1日あたり約20-25mgとされ、そのほとんど(>90%)はマクロファージから回収された鉄でまかなわれており13)、細胞剥離や発汗および出血などにより失われる1-2mgの鉄は、腸管から吸収され補われています10)。
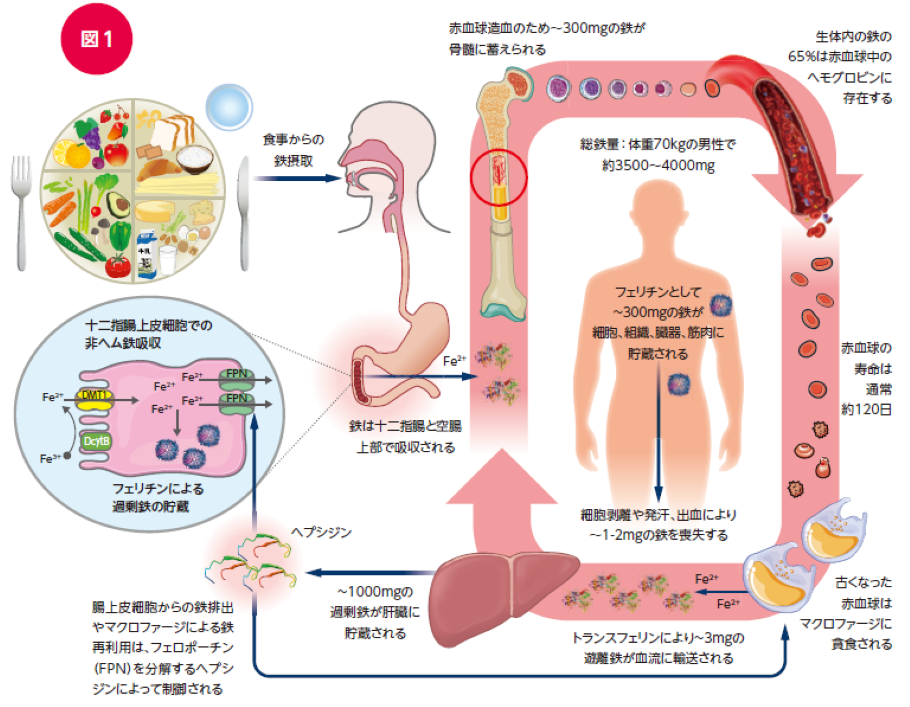
このように、ヒトにおいては鉄を積極的に排泄する仕組みはなく、加齢とともに蓄積します14)。
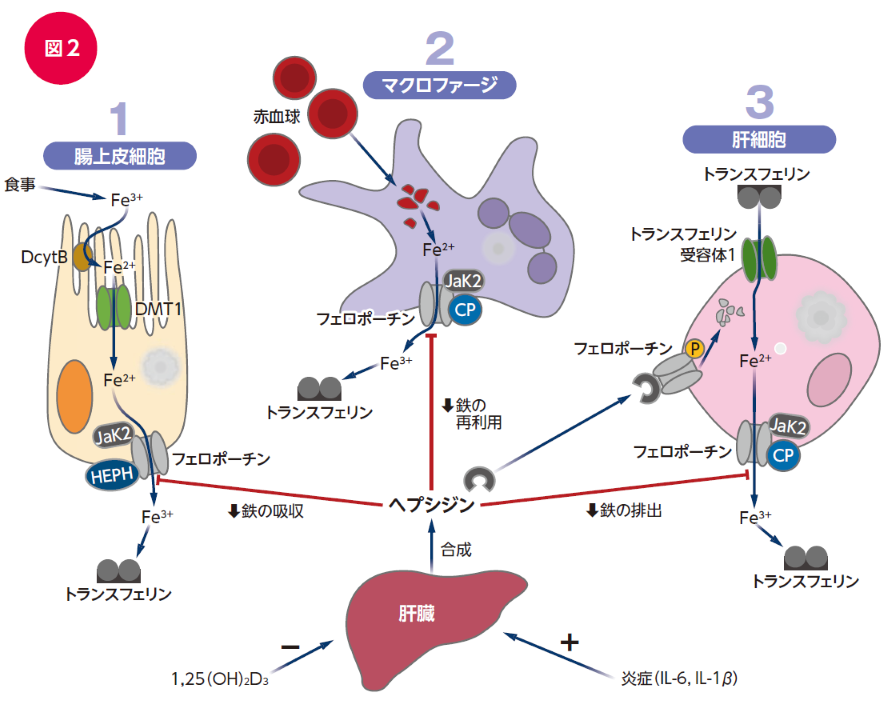
体内の鉄量を制御するにあたり、重要な役割を果たしている分子がフェロポーチンとヘプシジンです。
フェロポーチンは腸上皮細胞膜上に存在するタンパク質であり、細胞内に貯蔵された鉄を細胞外に汲み出す役割を担っています15)。
ヘプシジンは肝臓で産生されるペプチドホルモンでフェロポーチンと結合し、フェロポーチンを分解する作用を有します15)。
ヘプシジンの作用によりフェロポーチンの発現が腸上皮細胞やマクロファージで低下すれば、これらの細胞からの血液中への鉄の排出が抑制されます16)。
つまりヘプシジンは鉄利用の抑制因子として働きます。
生体内の鉄の飽和度が高くなればヘプシジンの転写が亢進し、鉄の吸収、再利用を抑える方向にシフトします(血中の鉄レベルの低下)17)。
鉄の飽和度上昇に加え、肝臓でのヘプシジン産生増加に働くのが炎症性サイトカインIL-6産生です17)。この機序は感染症に対する生体防御反応、すなわち、病原微生物の利用できる鉄を減らす反応と理解されます(図2)。
鉄をめぐるヒトと細菌のせめぎあい
ヒトなどの動物体内では、鉄はトランスフェリンやフェリチンなどの鉄結合タンパク質として存在しているため、細菌が簡単に利用できる遊離鉄濃度は極めて低く抑えられています。また、生体内においては感染防御の目的で、炎症が起こった際に、より強い鉄結合能を持つラクトフェリンが誘導産生されます18)。このように細菌は自然環境下および宿主内において常に鉄制限ストレスにさらされているため、進化の過程において、細菌はこの鉄制限ストレスを打破するために効率的な鉄取り込み機構を獲得してきたと考えられています。
細菌は菌種によって、様々な鉄獲得の方法を組み合わせて使用しており、その方法には例えば❶シデロフォアを分泌し、シデロフォアに結合した鉄(Fe3+)を受容体から取り込む、❷トランスフェリンやラクトフェリンを受容体から取り込む、❸ヘム結合タンパク質であるヘモフォアを分泌しヘモグロビンなどからヘムを奪い膜輸送体から取り込む、❹ヘムやヘムタンパク質を受容体から取り込む(図3)、などがありますが、なかでも、シデロフォアを介した鉄獲得メカニズムは最も一般的な手段とされています19)。
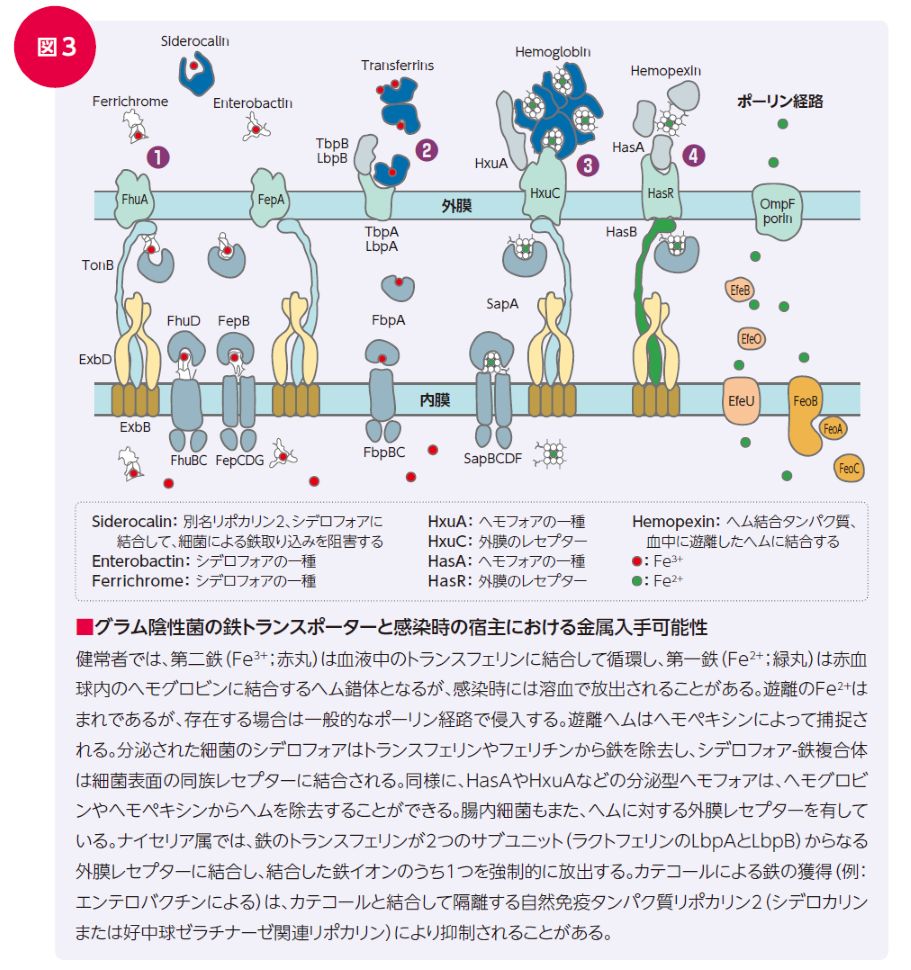
シデロフォア(ギリシャ語で鉄イオン運搬体を意味する)20)は、多くの細菌種が分泌する低分子の鉄キレート剤で、受容体を介して能動輸送により外膜からペリプラズム内に取り込まれます21)。
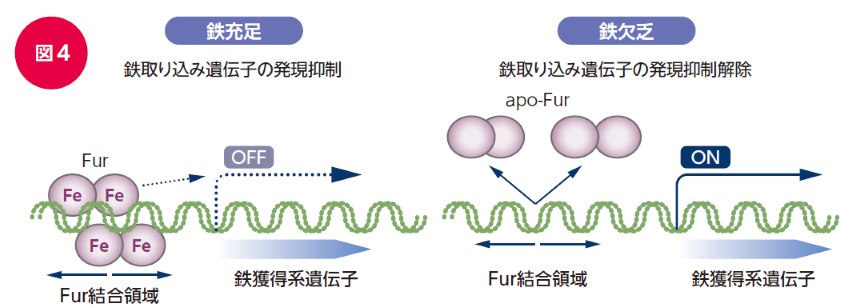
細菌のシデロフォア産生は、通常、鉄依存性転写制御因子(ferric uptake regulator; Furまたは一部のグラム陽性菌はジフテリア毒素抑制因子;diphtheria toxin repressor; DtxR)によって鉄依存的に制御されています22)。Furは鉄の取り込みに関与する遺伝子群の発現を抑制しており、鉄が充足した環境では標的プロモーターに結合することで鉄輸送体遺伝子の発現を抑制し、鉄が欠乏した環境ではFurによる転写抑制が解除され鉄の取り込みが促進されます(図4)。このように、Furは鉄のセンサーとして働き、鉄の恒常性を維持する上で重要な役割を果たしています。
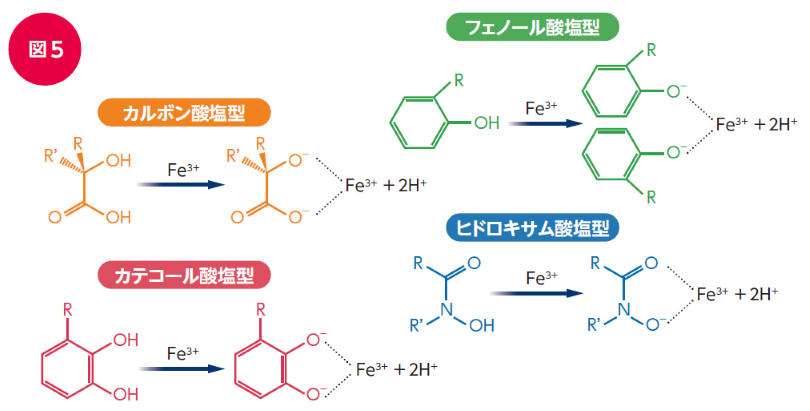
シデロフォアの鉄親和性は非常に高く、フェリチン、トランスフェリン、ラクトフェリンなど、鉄が結合する分子から鉄を奪い取ることができます23)。シデロフォアは、鉄とのキレート結合に関与する部位によって4つの化学型に分類されます(図5)。カルボン酸塩型、フェノール酸塩型、カテコール酸塩型、ヒドロキサム酸塩型であり、これらの混合型に分類されるものもあります。
細菌のシデロフォアのレパートリーは菌種によって、また菌株によっても異なるといわれています。
実際、シデロフォアを多く産生できる株は病原性が高く、シデロフォアを合成・分泌できない株は感染時の病原性・コロニー形成能力が低いことが確認されています24)。
大腸菌は、エンテロバクチン、サルモケリン、エルシニアバクチン、エアロバクチンの4種類のシデロフォアを産生することが報告されています。なかでもエンテロバクチンは鉄に対して最も親和性の高いシデロフォアとされています25)。
また、緑膿菌は、構造的・機能的に異なる2つのシデロフォア(ピオベルジンとピオケリン)を産生することが知られていますが、大腸菌や他の細菌が分泌するエンテロバクチンを利用することもできます26)。
このように他の細菌が産生するシデロフォアを利用する現象はゼノ(異種)シデロフォア利用などと呼ばれ、細菌が生存競争を勝ち抜き、より多くの鉄を獲得するために備わった機構と考えられています26)。
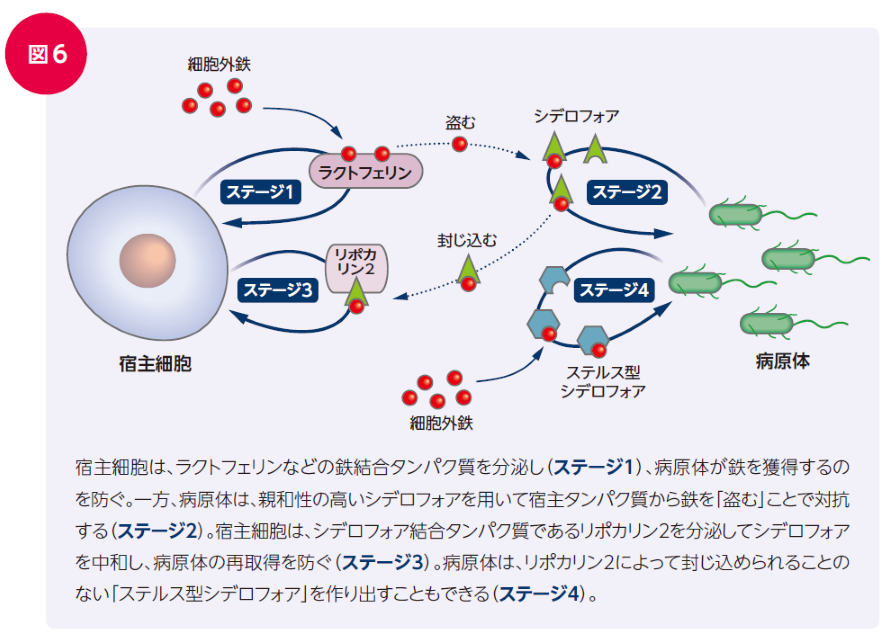
細菌が分泌するシデロフォアに対し、ヒトの免疫系は対抗するメカニズムを獲得してきました。リポカリン2(別名シデロカリン)は細菌のカテコール酸塩型鉄シデロフォアと結合することにより、その働きを失活させます27)。
これに対し、一部の細菌は、リポカリン2の結合を防ぐように糖鎖の修飾により改変されたステルス型シデロフォアを産生します(図6)。
このように進化の過程で、ヒトは細菌に鉄を与えない免疫機構を獲得し、細菌はヒトから鉄を奪う手段を獲得してきました。
医療におけるシデロフォアの利用
シデロフォアは、その高い鉄親和性を利用し、鉄キレート剤として鉄過剰症の治療に用いられており、現在、注射剤デフェロキサミンと経口剤デフェラシロクスの2剤が臨床使用されています28)。
デフェロキサミンはもともとは放線菌のシデロフォアです15)。
また、細菌が産生する抗生物質は、もともと他の細菌の発育を阻害するための化学物質と定義されていますが、放線菌の一種であるストレプトマイセス属の菌種には、シデロフォアと抗生物質の複合体を産生するものが確認されています29)。このような複合体は総称してシデロマイシンと呼ばれていますが、細菌が生育するために鉄を取り込むことを利用して、細菌を殺すための抗生物質を細菌内に送り込むことから、 トロイの木馬型抗生物質 と呼ばれています29)。このようなシデロフォアを結合したトロイの木馬型抗生物質は、自然界で産生されるものだけではありません。人工的にシデロフォア構造と抗生物質をつなぎ合わせた化合物を創製し、新規抗菌薬として評価することは1980年頃より試みられており、数多くの新規物質が創製されてきましたが、いずれも上市には至りませんでした。
しかしながら2023年11月、シデロフォアセファロスポリン系抗菌薬Cefiderocol(セフィデロコル)が日本において新薬として承認を受け、同年12月に発売されました。世界で唯一のトロイの木馬型抗生物質であり、カルバペネム耐性グラム陰性菌感染症治療の新たな治療選択肢として期待されます。
References
1) Andrews, SC.,et al.: FEMS Microbiol Rev., 2003, 27(2-3), 215
2) Shen, Y., et al.: Nature, 2001, 410(6824), 77
3) Weiss, MC., et al.: PLoS Genet., 2018, 14(8), e1007518
4) 岩井一宏ほか: 生化学, 2007, 79(11), 1021
5) 山本純之ほか: 地学雑誌, 2013, 122(5), 791
6) 城宜嗣: Biomed Res Trace Elements, 2011, 22(4), 50
7) 増田建: 光合成研究, 2012, 22(2), 115
8) 中塚由加里ほか: 関税中央分析所報 第57号, 41
9) 織田浩嗣: Milk Science, 2013, 62(3), 105
10) 目黒邦昭: 仙台医療センター医学雑誌, 2017, 7, 3
11) 森潔ほか: 日本内科学会雑誌, 2010, 99(6), 1188
12) 山本裕康: 日本内科学会雑誌, 2015, 104(5), 960
13) Drakesmith, H., et al.: Cell Metab., 2015, 22(5), 777
14) Cook, JD., et al.: Blood, 2003, 101(9), 3359
15) 張替秀郎: 日本内科学会雑誌, 2013, 102(10), 2699
16) 張替秀郎: 日本内科学会雑誌, 2018, 107(9), 1921
17) 茂呂寛: 日本化学療法学会雑誌, 2019, 67(2), 169
18) Legrand, D., et al.: Cell Mol Life Sci., 2005, 62(22), 2549
19) Kramer, J., et al.: Nat Rev Microbiol., 2020, 18(3), 152
20) Robinson, AE., et al.: Future Microbiol., 2018, 13(7), 813
21) Aksoyalp, ZS., et al.: J Trace Elem Med Biol., 2023, 75, 127093
22) Deng, Z., et al.: Nat Commun., 2015, 6, 7642
23) Page, MGP.: Clin Infect Dis., 2019, 69(Suppl 7), S529
24) Khasheii, B., et al.: Microbiol Res., 2021, 250, 126790
25) Moynié, L., et al.: Nat Commun., 2019, 10, 3673
26) Sánchez-Jiménez, A., et al.: Microb Biotechnol., 2023, 16(7), 1475
27) Golonka, R., et al.: J Innate Immun., 2019, 11(3), 249
28) 鈴木隆浩: 北里医学, 2017, 47, 1
29) Terra, L., et al.: Curr Med Chem., 2021, 28(7), 1407

