海外第Ⅲ相試験(ID-078A301試験)
海外第Ⅲ相試験(ID-078A301試験):海外データ1)
試験概要
- 目的
-
不眠障害患者を対象としたクービビックの有効性及び安全性を検討する。
- 試験デザイン
-
多施設共同、二重盲検、無作為化、プラセボ対照、並行群間、睡眠ポリグラフ試験
- 対象
-
不眠障害を有する成人及び高齢患者930例
<主な登録基準>
・18歳以上、BMIが18.5kg/m2以上40.0kg/m2以下の男女
・DSM-5に基づき不眠障害と診断された患者
・ 来院1回目の不眠重症度指数(ISI)スコアが15以上の患者
・ 来院2回目から3回目の期間7日間で記入した睡眠日誌において、3夜以上で以下のすべてに該当する患者
(a)主観的睡眠潜時(sLSO)30分以上 (b)主観的中途覚醒時間(sWASO)30分以上
(c)主観的総睡眠時間(sTST)6.5時間以下
・ 来院2回目から3回目の期間7日間で記入した睡眠日誌において、普段の就床時刻が21:30~00:30、就床時間が6時間から9時間と報告した患者
・ 来院3回目に2夜のPSGにより測定した睡眠パラメータが以下の基準をすべて満たす患者
(a)持続入眠潜時(LPS)の平均値が20分以上(2夜のいずれでも15分未満ではない)
(b)中途覚醒時間(WASO)の平均値が30分以上(2夜のいずれでも20分未満ではない)
(c)総睡眠時間(TST)の平均値が420分未満
・ 慢性閉塞性肺疾患及び睡眠時無呼吸などの睡眠関連呼吸障害の既往歴がなく、合併のない患者
・ 急性又は不安定な精神状態(不安障害、大うつ病、双極性障害、統合失調症、強迫性障害、又はうつ病を含むが、これらに限定されない)と診断されていない患者、大うつ病の既往歴を有するが、無症状で、同意取得時に治療不要であった患者 - 方法
-
被験者は、スクリーニング期(7~18日間)と、これに続く単盲検のプラセボrun-in期(13~24日間)の後、クービビック25mg、50mg又はプラセボに、それぞれ1:1:1の比で無作為に割付けられた。無作為に割付け後、二重盲検下にて治験薬を1日1回就寝前に12週間経口投与し、その後7日間を単盲検にてプラセボ投与するプラセボrun-out期とした。
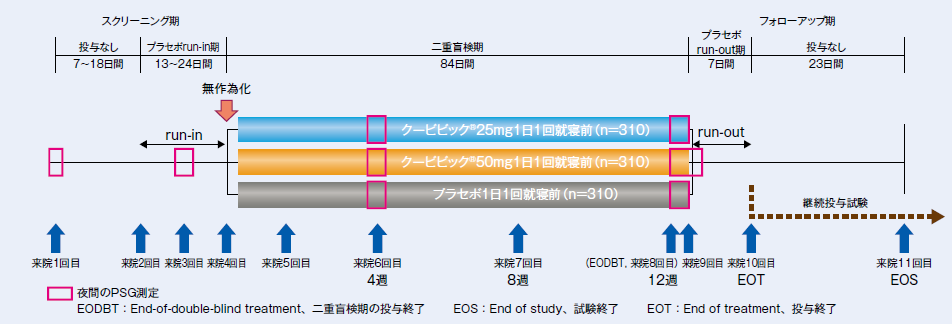
- 評価項目
-
主要評価項目(有効性):検証的解析項目
・中途覚醒時間(WASO)の4週時注1) 及び12週時注1) におけるベースライン注2) からの変化量
・持続入眠潜時(LPS)の4週時注1) 及び12週時注1) におけるベースライン注2) からの変化量
副次評価項目(有効性):
・主観的総睡眠時間(sTST)の4週時注3) 及び12週時注3) におけるベースライン注4) からの変化量
・IDSIQ Sleepinessスコアの4週時注3) 及び12週時注3) におけるベースライン注4) からの変化量
探索的評価項目:
・ IDSIQの各スコア(Sleepinessスコア以外)の4週時注3) 及び12週時注3) におけるベースライン注4) からの変化量
安全性評価項目:
・ 二重盲検期終了(中止)後30日又は継続投与試験に移行するまでに治療下で発現した有害事象(TEAE)
・ 二重盲検期終了(中止)後30日又は継続投与試験に移行するまでに発現した重篤な有害事象
・ 二重盲検期の早期治験薬投与中止に至った有害事象 等
注1)4週時、12週時:来院6回目、8回目それぞれの2夜PSG測定での平均値
注2)ベースライン:来院3回目の2夜PSG測定での平均値
注3)4週時、12週時:来院6回目、8回目それぞれの最初のPSG測定の直前7日間に被験者が自宅で実施した睡眠日誌/IDSIQの記入データにおける平均値
注4)ベースライン:来院3回目の最初のPSG測定の直前7日間に被験者が自宅で実施したスクリーニング睡眠日誌/IDSIQの記入データにおける平均値
- 解析計画
-
解析対象集団:
有効性の解析対象集団は、無作為化され少なくとも1回治験薬を投与されたすべての患者(FAS)、安全性の解析対象集団は治験薬を1回以上投与されたすべての患者とした。主要評価項目(WASO及びLPS)及び副次評価項目(sTST及びIDSIQ Sleepinessスコア)それぞれについて、2用量に対する計16の帰無仮説検定を実施した。両側有意水準5%で試験全体の第1種過誤を制御するため、Bonferroni法に基づくゲートキーピング法を用い、主要及び副次評価項目のそれぞれ2つの項目を両側 5%の半分の有意水準で、それぞれ4週時の高用量群とプラセボ群の比較、12週時の高用量群とプラセボ群の比較、4週時の低用量群とプラセボ群の比較、12週時の低用量群とプラセボ群の比較の順で検定を行った。
評価項目のベースラインからの変化量は、各応答変数(WASO、LPS、sTST、又はIDSIQ sleepinessスコア)のベースライン値、年齢区分(65歳未満、65歳以上)、投与群(高用量群、低用量群、プラセボ)、評価時点(4週時、12週時)、投与群と評価時点の交互作用項及びベースライン値と評価時点の交互作用項を適用した線形混合効果モデルを用いて解析し、対象の群間差を検定した。

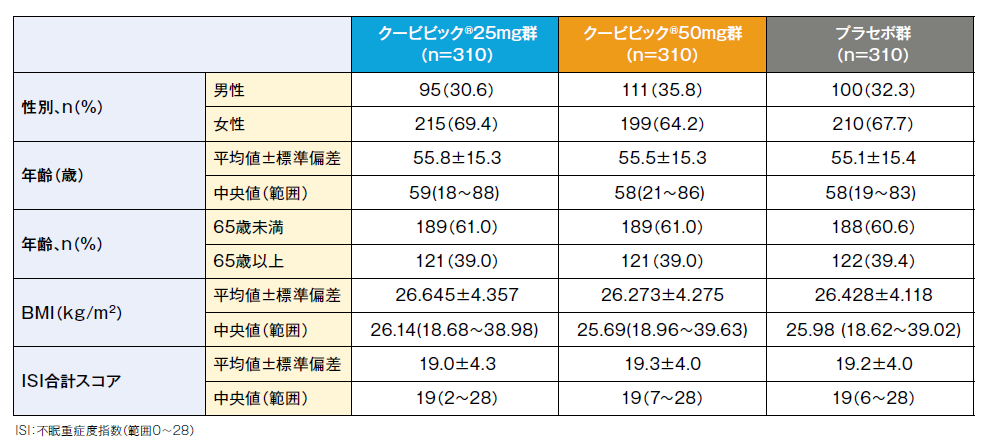
患者背景(FAS)
有効性:主要評価項目(検証的解析結果)、副次評価項目
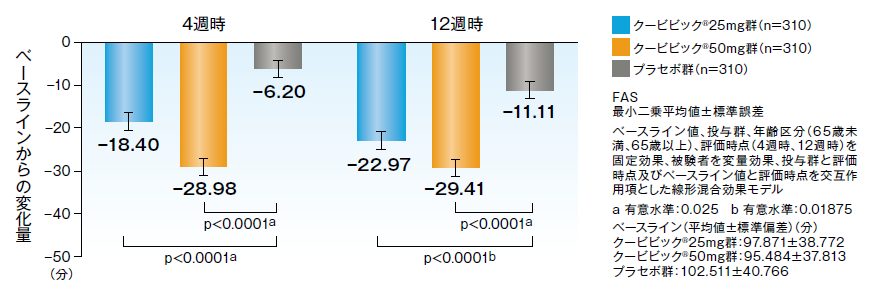
持続入眠潜時(LPS)
クービビック50mg群、クービビック25mg群の4週時、12週時において、プラセボ群に対する持続入眠潜時(LPS)の優越性が検証されました。
LPSの4週時及び12週時におけるベースラインからの変化量【主要評価項目】(検証的解析結果)
LPSの4週時及び12週時におけるベースラインからの変化量のプラセボ群との差(最小二乗平均値)[95%CI]は、クービビック50mg群において-11.35分[-16.022~-6.687]及び-11.67分[-16.348~-6.994]、クービビック25mg群において-8.32分[-13.014~-3.629]及び-7.59分[-12.265~-2.923]であり、プラセボ群に対する優越性が検証されました。
中途覚醒時間(WASO)
クービビック50mg群、クービビック25mg群の4週時、12週時において、プラセボ群に対する中途覚醒時間(WASO)の優越性が検証されました。
WASOの4週時及び12週時におけるベースラインからの変化量【主要評価項目】(検証的解析結果)
WASOの4週時及び12週時におけるベースラインからの変化量のプラセボ群との差(最小二乗平均値)[95%CI]は、クービビック50mg群において-22.78分[-27.996~-17.567]及び-18.30分[-23.945~-12.661]、クービビック25mg群において-12.20分[-17.435~-6.961]及び-11.86分[-17.494~-6.230]であり、プラセボ群に対する優越性が検証されました。
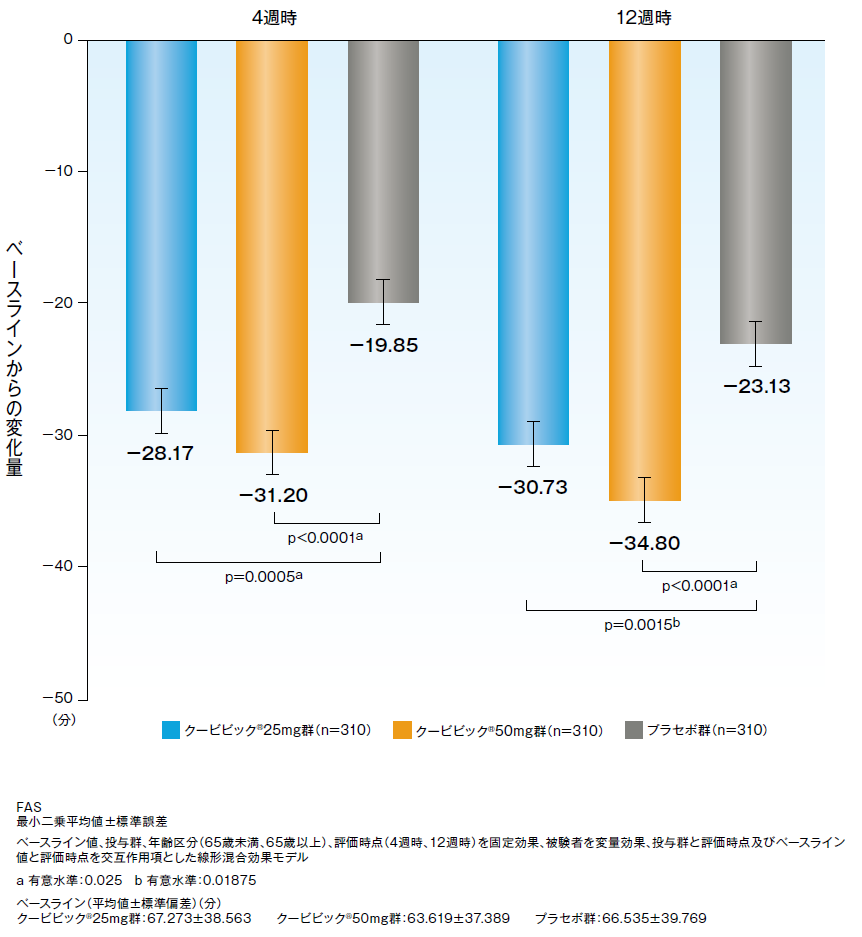
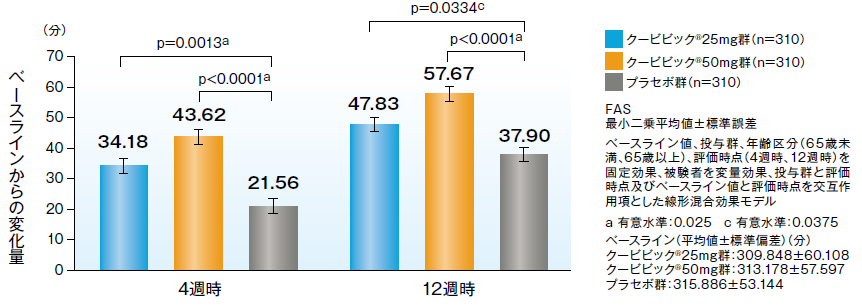
主観的総睡眠時間(sTST)
クービビック50mg群、クービビック25mg群は4週時、12週時のいずれにおいても、プラセボ群に比べ主観的総睡眠時間(sTST)の有意な延長が認められました。
sTSTの4週時及び12週時におけるベースラインからの変化量【副次評価項目】
sTSTの4週時及び12週時におけるベースラインからの変化量のプラセボ群との差(最小二乗平均値)[95%CI]は、クービビック50mg群において22.06分[14.405~29.708]及び19.77分[10.623~28.918]、クービビック25mg群において12.62分[4.953~20.288]及び9.93分[0.782~19.082]であり、プラセボ群に比べ有意な延長が認められました。
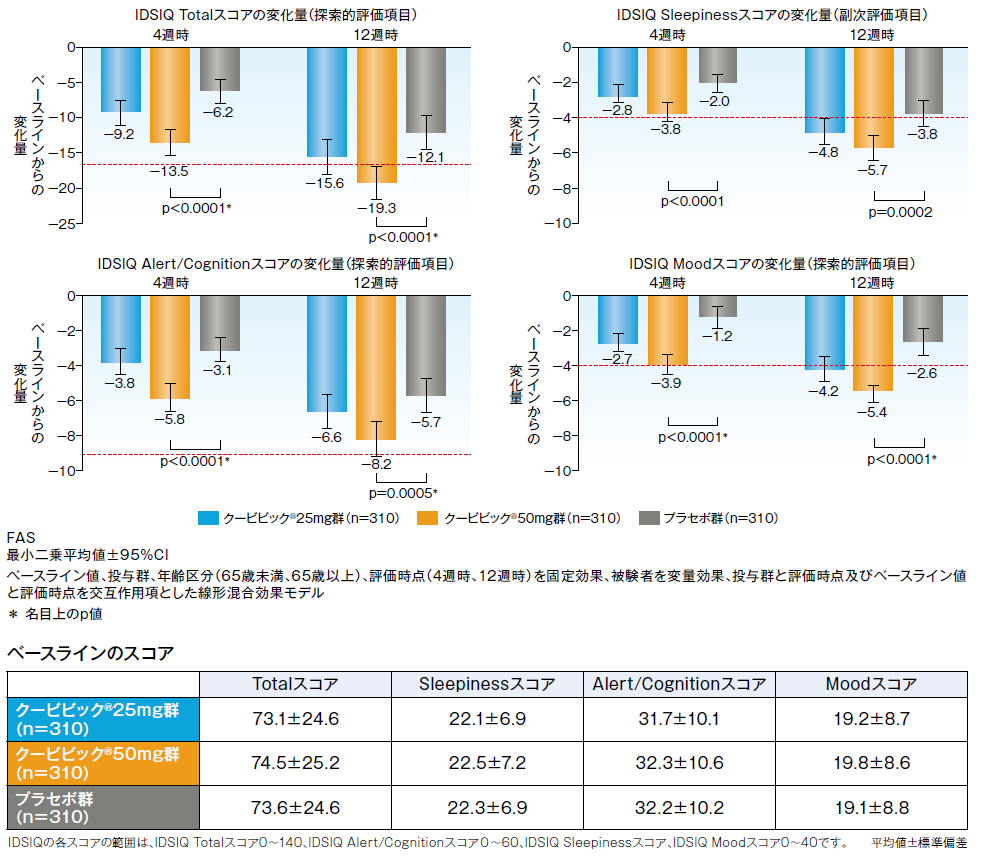
IDSIQ(副次評価項目、探索的評価項目)
IDSIQスコアの4週時及び12週時におけるベースラインからの変化量【副次評価項目、探索的評価項目】
副次評価項目であるIDSIQ Sleepinessスコアの4週時及び12週時におけるベースラインからの変化量のプラセボ群との比較において、クービビック50mg群で有意な低下が認められました。
探索的評価項目であるTotalスコア、Alert/Cognitionスコア、Moodスコアの4週時及び12週時におけるベースラインからの変化量のプラセボ群との比較において、クービビック50mg群で有意な低下が認められました(いずれも多重性を考慮していない名目上の有意差あり)。
●Totalスコア 17点 ●Sleepinessスコア 4点 ●Alert/Cognitionスコア 9点 ● Moodスコア 4点
意味のある変化量を算出するために、海外の承認時評価試験とされた海外第Ⅲ相試験(ID-078A301)1) のデータを用いました。被験者は、二重盲検治療期間を通じて、毎日夕方にIDSIQの記録を行い、スコアは週平均として計算されました(各IDSIQ項目の評価スケールについては、「日中の機能を評価する指標」をご参照ください)。患者による疾患重症度の全般評価(PGA-S)、患者による重症度の全般的印象(PGI-S)、患者による変化の全般的印象(PGI-C)及びISI合計スコアは、治療前後の患者の有意な変化を推定するための潜在的なアンカーとして評価され、アンカーのスコア変化/評価とIDSIQの関係に関するスピアマン相関係数(4週時で0.36~0.44、12週時で0.45~0.57)は、すべて事前に規定された閾値0.30を上回りました。また、PGA-S、PGI-Sでは1~2点の減少、PGI-Cでは「少し改善した」「中程度に改善した」、ISIは6点の減少が、「臨床的に関連するスコアの変化」とされており3,4) 、その閾値に達した患者のIDSIQスコアに基づき、意味のある変化量が算出されました。
本解析については以下のlimitationが存在します2) 。
● 対象患者は中等度から重度の不眠症患者であり、日常臨床で治療を受けている多くの患者を代表するものではない可能性がある。
● 対象患者は主に白人であったため、人種的・民族的多様性を十分に反映していない可能性がある。
● 対象となった臨床試験では、不眠症による日中の症状のベースラインの基準は設定していなかったため、一般的な不眠症患者の日中の症状を反映していない可能性がある。
● 試験期間(12週)だけでは、治療による患者の変化を正確に反映していない可能性がある。
安全性
- 二重盲検期において、有害事象はク-ビビック50mg群で37.7%(116/308例)、25mg群で37.7%(117/310例)、プラセボ群で34.0%(105/309例)に、副作用は50mg群で12.3%(38/308例)、25mg群で12.9%(40/310例)、プラセボ群で9.4%(29/309例)に発現しました。主な副作用は傾眠[50mg群1.6%(5/308例)、25mg群2.6%(8/310例)、プラセボ群1.6%(5/309例)]でした。
- 重篤な副作用は、本試験においてクービビック群では認められず、プラセボ群で失神が1例に認められました。
- 二重盲検期に投与中止に至った副作用は50mg群で0.6%(2/308例)、25mg群で1.9%(6/310例)、プラセボ群で1.3%(4/309例)に認められました。その内訳は、50mg群で上室性期外収縮、腎機能障害が各1例(0.3%)、25mg群で浮動性めまい2例(0.6%)、抑うつ気分、鎮静合併症、睡眠の質低下、睡眠時麻痺が各1例(0.3%)、プラセボ群で失神、耳鳴、不眠症、鎮静合併症が各1例(0.3%)でした。
- 本試験において、死亡に至った副作用は報告されませんでした。
日中の機能を評価する指標
~Insomnia Daytime Symptoms and Impacts Questionnaire(IDSIQ)とは~
IDSIQとは、被験者による日中の眠気や気分の程度に関する質問への自己報告に基づき、医師が不眠障害における日中の症状に対する有効性を評価する指標で、数値が小さいほど日中の機能障害が小さいことを示します。

●IDSIQは、睡眠の質を評価することを目的にピッツバーグ大学にて作成されたDaytime Insomnia Symptom Scale6) を再構成し、イドルシア社が新たに開発した評価ツールです。本評価ツールはFDAのPROガイダンスに従い開発され、不眠症評価指標として信頼できる、と評価されています5) 。
●IDSIQの日本語版は、海外第Ⅲ相試験で用いたIDSIQの日本語訳を使用しました。日本語版作成にあたっては、睡眠日誌と同様に日本製薬工業協会データサイエンス部会「治験におけるPatient Reported Outcomes-臨床開発担当者のためのPRO利用の手引き-」[日本製薬工業協会2016]を参照し、不眠症患者を対象としたインタビューを含む言語バリデーションを行いました7) 。
●本指標については以下のlimitationが存在します5) 。
・同時妥当性の分析に日中機能を評価するための評価指標が含まれていない。
・介入研究に参加した被験者はISIスコアが15以上であることが必要であったため、軽症の不眠症患者におけるIDSIQの妥当性は確立されていない。
・IDSIQは今のところ短期間の薬剤使用でしか検証されておらず、長期の治療効果評価については確立されていない。
References
1) 社内資料:不眠症患者を対象とした海外第Ⅲ相試験[ID-078A301試験](承認時評価資料)
2) Phillips-Beyer A, et al.: Pharmaceut Med. 2023; 37(4): 291-303.(本研究はIdorsia Pharmaceuticalsの支援により実施された。)
3) Yang M, et al.: Curr Med Res Opin. 2009; 25(10): 2487-2494.
4) Omachi TA.: Arthritis Care Res(Hoboken). 2011; 63 Suppl 11(0 11): S287-S296.
5) Hudgens S, et al.: Patient. 2021; 14(2): 249-268.(本研究はIdorsia Pharmaceuticalsの支援により実施された。)
6) Buysse DJ, et al.: Sleep Med. 2007; 8(3): 198-208.
7) 社内資料:主な他の有効性評価(承認時評価資料)

